Chimie de l'eau: acides, bases, pH et alcalinité
Résumé
Dans cette leçon, les jeunes exploreront les acides et les bases en relation avec la qualité de l'eau, en mettant l'accent sur leur impact sur les organismes et écosystèmes aquatiques. Les élèves utiliseront les bandelettes de test Water Rangers pour étudier les propriétés des acides et des bases et les relier au pH et à l'alcalinité, en explorant comment le pH change avec les produits ménagers quotidiens et en testant les niveaux de pH dans leur environnement local.
Toutes nos leçons sont conçues en deux parties: une composante en classe et une composante sur le terrain. Vous pouvez choisir de suivre les leçons successivement sur plusieurs jours, à un moment qui vous convient, ou d'enseigner l'une ou l'autre partie de manière indépendante. Les leçons sont présentées sous forme d'activités en petits groupes pour faciliter et encourager la participation active. Au bas de la page, vous trouverez une section sur les connexions entre l'océan et le monde réel, des liens externes vers des ressources d'apprentissage et des activités supplémentaires à essayer, ainsi qu'un glossaire de termes.
Années d'étude recommandées
Ces activités sont recommandées pour les jeunes de 8e à 10e années. Nous avons inclus des conseils pour adapter les activités à un large éventail d'élèves tout au long de la leçon.
Résultats d'apprentissage
- Utiliser des bandelettes de test pour enregistrer les résultats du pH.
- Évaluer l’impact potentiel des produits ménagers et de la pollution sur la qualité de l’eau.
- Relier les propriétés acide/base à leurs positions respectives sur l’échelle de pH.
- Reconnaître l'importance du pH dans la détermination des conditions de l'eau pour soutenir la vie aquatique.
Comment utiliser les bandelettes de test Water Rangers
Dans cette vidéo, Kat explique comment utiliser et lire les mesures sur les bandelettes de test Water Rangers.
Contexte
Acides et bases
Les acides et les bases jouent un rôle crucial dans l'évaluation de la qualité de l'eau, influençant les conditions qui soutiennent la vie aquatique. Les acides sont souvent décrits comme ayant un goût aigre, tandis que les bases peuvent être qualifiées de glissantes ou amères. Au niveau atomique, les acides libèrent des ions d'hydrogène dans l’eau et abaissent le niveau de pH. Les bases, quant à elles, acceptent les ions d'hydrogène, augmentant le niveau de pH et influençant l’alcalinité – les bases sont également appelées alcalines.
pH et échelle de pH
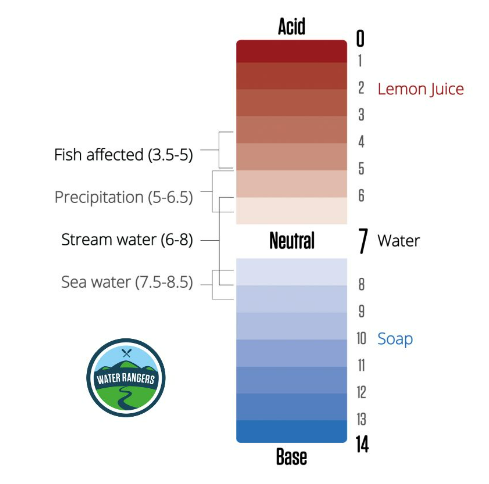
pH signifie « potentiel d'hydrogène » et l'échelle de pH est une mesure du degré d'acidité ou de base d'une substance. Il va de 0 (très acide) à 14 (très basique), 7 étant neutre. Le pH détermine les conditions qui déterminent la facilité avec laquelle les nutriments sont disponibles pour les organismes aquatiques et la facilité avec laquelle les substances toxiques peuvent se dissoudre dans l'eau. Différentes espèces prospèrent dans différentes plages de pH, et les plans d’eau peuvent varier entre 5 (acide) et 9 (basique). Vous devrez créer une référence pour déterminer quel est le niveau de pH normal pour votre plan d’eau local!
Conseil pour prof!
Pour un public plus jeune, utilisez un langage pertinent et des exemples sensoriels pour expliquer le pH! Les acides ont généralement un goût aigre (comme un citron) et les bases sont glissantes (comme du savon liquide pour les mains). Vous pouvez leur demander de dessiner leur propre échelle de pH en fonction des articles ménagers qu'ils testent ou des aliments qu'ils connaissent dans le cadre de l'activité en classe.
Alcalinité
L'alcalinité est la capacité de l'eau à neutraliser l'acide ou à résister aux baisses de pH. Il agit comme un tampon contre les changements rapides de pH et est important pour maintenir une plage de pH stable. Le pH et l'alcalinité de l'eau sont affectés par les minéraux inorganiques comme les roches et le sol, ainsi que par la matière organique provenant des plantes, des bactéries et des champignons. Le calcaire, par exemple, peut augmenter l’alcalinité. La mesure de l'alcalinité est exprimée en milligrammes par litre (mg/L) ou en parties par million (ppm) de carbonate de calcium (CaCO₃) dans un échantillon d'eau. Bien qu'une alcalinité élevée n'implique pas nécessairement une mauvaise qualité de l'eau, chaque plan d'eau a son niveau normal unique déterminé par des facteurs et influences environnementaux. Une fois que vous avez trouvé l’alcalinité de base d’un plan d’eau, vous remarquerez qu’elle reste assez stable dans le temps.
Observer l'évolution du pH avec des produits ménagers courants
Lieu: Dans la classe
Durée: 45 minutes
Objectif: Utilisez des bandelettes de test pour observer les changements de pH causés par les produits ménagers courants.
Groupes: Nous recommandons 5 étudiants maximum par groupe pour cette activité.
Matériaux nécessaires
- Papier et crayon
- Bandelettes de test Water Rangers dans leur contenant
- Minimum 4 coupelles d'échantillon par groupe (verres, béchers, flacons ou plaques d'identification)
- Eau à échantillonner (l'eau du robinet, c'est bien!)
- Minimum de 3 liquides ménagers. Vous pouvez utiliser du jus de citron, du vinaigre, du savon à vaisselle, des produits de nettoyage non caustiques – faites preuve de créativité!
Préparation
- Assurez-vous que chaque groupe dispose du matériel répertorié ci-dessus, y compris des contenants de bandelettes de test avec des tableaux indicateurs. Notre trousse éducative est livré avec trois contenants pour étudiants avec le tableau indicateur au dos ainsi qu'un contenant de recharge qui a également le tableau au dos. Ils doivent disposer d’au moins une bandelette de test par liquide domestique qu’ils vont tester.
- Préparez les liquides ménagers dans chaque gobelet à échantillon pour un accès facile pendant l'activité. Vous pouvez également utiliser des plaques d'identification ou des microplaques pour minimiser les déchets.
- Les élèves échantillonneront l’eau du robinet à titre de contrôle. Le traitement de l'eau diffère d'une région à l'autre, et si vous soupçonnez un pH autre que 7 pour votre eau du robinet, vous pouvez utiliser de l'eau distillée à la place.
- Regardez la courte vidéo ci-dessus pour vous familiariser avec les bandelettes de test Water Rangers et leur utilisation pour aider efficacement les élèves.
- Prévoyez un endroit désigné pour que les élèves puissent éliminer les liquides de manière sûre et respectueuse de l'environnement. Votre trousse contient une grande enveloppe pour contenir les bandelettes de test usagées qui peuvent être renvoyées à Water Rangers pour un recyclage approprié.
Étapes
1. Tester votre échantillon de contrôle
Conseil pour prof!
Pour les étudiants plus âgés, encouragez-les à approfondir la chimie derrière le pH. Discutez du rôle des ions hydrogène (H+) et des ions hydroxyde (OH-) dans la détermination de l’acidité et de l’alcalinité. Pour chaque produit ménager, introduisez des équations chimiques simples représentant leurs réactions dans l’eau.
- Assurez-vous que les mains des élèves sont sèches avant d'utiliser les bandelettes de test.
- Demandez à chaque groupe de prélever un échantillon d’eau et d’y tremper une bandelette de test pendant 2 secondes.
- Après 20 secondes, chaque groupe peut utiliser le tableau indicateur au dos de son contenant de bandelettes réactives pour comparer la couleur de la bandelette réactive.
- Au moins deux personnes doivent comparer les couleurs ensemble et s'assurer qu'elles sont d'accord sur la lecture.
- Enregistrez la lecture initiale du pH. Cela leur servira de contrôle. Un échantillon témoin est une mesure qui sert de point de comparaison dans une expérience!
2. Changer le pH
- Chaque groupe doit prélever un autre échantillon d’eau et ajouter une très petite quantité d’un produit ménager.
- Demandez-leur de tester le pH de l’échantillon modifié et d’enregistrer leurs résultats.
- Répétez cette étape pour chaque produit ménager fourni.

3. Dessin et réflexion
- Demandez aux élèves de dessiner une échelle de pH simple et de l’étiqueter.
- Encouragez les élèves à réfléchir à d’autres facteurs qui pourraient modifier le pH.
Conseil pour prof!
La section discussion et réflexion peut être utilisée pour évaluer les connaissances des étudiants.
Questions de discussion
- Quel produit ménager a le plus modifié le pH? (Repensez à votre échantillon de contrôle!)
- Différents produits ont-ils entraîné des lectures de pH plus élevées ou plus basses? Que signifient les lectures de pH supérieures/inférieures?
- Compte tenu de ce que vous savez de ces produits ménagers, comment décririez-vous un acide? Comment décririez-vous une base?
- Comment une eau à pH élevé/faible peut-elle affecter les organismes vivant dans l’écosystème aquatique?
Explorer le pH à l'extérieur
Lieu: Sur le terrain, près d'un plan d'eau local. Par exemple, une flaque d’eau, un ruisseau, un lac ou un étang!
Durée: 45 minutes
Objectif: Effectuez des enquêtes sur le pH de votre plan d’eau local.
Groupes: Nous recommandons 5 étudiants maximum par groupe pour cette activité.

Matériaux nécessaires
- Bandelettes de test
- Gobelets d'échantillons (un par groupe)
- Bâtons d'atteinte
- Bloc-notes et stylos
Avez-vous votre trousse éducative?
Tout le matériel pour les activités de plein air se trouve dans la trousse éducative Water Rangers.
Trousse éducativeRéférez-vous toujours aux conseils de sécurité contenus dans le guide de l'éducateur, ainsi qu'à notre guide pour choisir un un emplacement de test lors des tests à l'extérieur.
Étapes
1. Observations
- Demandez aux élèves d’observer leur environnement. Encouragez-les à mentionner toute source naturelle susceptible d’influencer le pH de l’eau. Cela peut inclure des roches, de la terre, de la végétation ou d’autres éléments.
- Que voient-ils/remarquent-ils?
- Quels sons entendent-ils?
- Que sentent-ils?
- Demandez aux élèves de considérer le paysage et les caractéristiques environnantes. Y a-t-il des zones avec beaucoup de végétation en décomposition? Le sol est-il sableux ou rocheux? Ces observations serviront d’indices pour prédire le pH.
2. Prédiction
- Sur la base de leurs observations physiques, demandez à chaque groupe de faire des prédictions sur le pH de l'eau. Pensent-ils que l’environnement est plus susceptible d’avoir des conditions acides ou basiques? Demandez-leur de justifier leurs prédictions.
3. Test de pH
Suggestions d'enrichissement
Consultez ce tableau de niveaux de pH critiques pour les organismes aquatiques. Discutez des raisons pour lesquelles certains organismes peuvent être plus sensibles aux changements de pH que d’autres et de ce qui leur arrive à certains niveaux de pH. Par exemple, les coquilles d’escargots sont constituées de carbonate de calcium et un pH faible entraînera la détérioration de leurs coquilles. De plus, de faibles niveaux de pH peuvent affecter les branchies des poissons et leur capacité à se reproduire.
Questions de discussion
Comment les différents niveaux de pH affectent-ils les organismes aquatiques?
Qu’est-ce que cela signifie pour les organismes aquatiques locaux de votre environnement?
- Distribuez des blocs-notes et des stylos à chaque groupe pour enregistrer leurs mesures.
- Distribuez les bandelettes de test, les bâtons d'atteinte et les gobelets à échantillons à chaque groupe.
- Rappelez aux élèves de rincer le gobelet à échantillon trois fois et de s’assurer que leurs mains sont sèches avant d’utiliser les bandelettes.
- Demandez aux élèves de prélever un échantillon d’eau à l’aide des bâtons d'atteinte et des gobelets à échantillons.
- Demandez-leur de plonger la bandelette entière dans l’eau échantillonnée pendant 2 secondes, puis d’attendre 20 secondes avant de lire les résultats.
- Par paires, comparez les couleurs des bandelettes avec le guide au dos du récipient pour déterminer la valeur du pH.
4. Réflexion et discussion
- Après les tests, donnez à chaque groupe le temps de réfléchir à ses prédictions et de les comparer aux résultats réels du pH.
- Animez une discussion en classe où les groupes peuvent partager leurs observations, leurs prédictions et leurs résultats de tests. Discutez des surprises ou des tendances observées dans les différents domaines testés.
- Pour un défi supplémentaire, vous pouvez encourager les élèves à explorer le lien entre leurs observations de pH et l'impact potentiel sur la vie aquatique. Comment les niveaux de pH observés pourraient-ils influencer les types d’organismes qui pourraient prospérer dans ces environnements?
- De retour en classe, vous pouvez enregistrer le pH de votre plan d'eau local en calculant la moyenne des résultats des élèves et télécharger les données sur notre plateforme!
Questions de discussion
- Y a-t-il eu des résultats inattendus lors de vos tests de pH?
- Quelles sont les causes naturelles qui affectent le pH de l’eau?
- Quelles sont les causes d’origine humaine qui affectent le pH de l’eau?
Connexions océaniques
L'acidification de l'océan
L'océan absorbe environ 30 % du dioxyde de carbone (CO2) qui est rejeté dans l'atmosphère. Depuis le début de la révolution industrielle, alors que les niveaux de dioxyde de carbone dans l’atmosphère ont augmenté en raison des activités humaines, le pH des eaux de surface des océans a diminué de 0.1. Bien que cela ne semble pas grand-chose, l'échelle de pH est logarithmique, ce changement signifie donc une augmentation d'environ 30 % de l'acidité de l'océan (NOAA). Le pH moyen de l'océan se situe désormais autour de 8.1 (basique), mais à mesure que l'océan continue d'absorber davantage de CO2, le pH continuera de baisser et l’océan deviendra plus acide.
Apprenez-en davantage sur les impacts chimiques et biologiques de l’acidification des océansConnexions à l'actualité
Les puits de carbone de la Saskatchewan
La Saskatchewan est connue pour ses lacs salés, comme le Petit Manitou, également appelés « lacs de soude ». Ces lacs ont un pH alcalin, ce qui signifie qu'ils sont basiques plutôt qu'acides. En raison du lien entre le pH et le CO2 , les lacs de la Saskatchewan peuvent agir comme des puits de carbone.
Apprenez-en davantage sur les lacs alcalins et les puits de carbone de la Saskatchewan dans notre article de blog.Liens vers le programme d'études
Consultez les liens avec les programmes d'études pour voir comment ces activités s'intègrent dans le curriculum des différentes provinces.
Ressources additionnelles
Ressources de cours
Association nationale océanique et atmosphérique (NOAA): Acidification des océans
Activités supplémentaires
ThoughtCo: Comment fabriquer un indicateur de pH au chou rouge
Essayez cette activité et réalisez votre propre solution d’indicateur de pH à partir de jus de chou rouge! Le jus de chou rouge possède un indicateur de pH naturel qui change de couleur en fonction de l'acidité d'une solution. C'est amusant, simple et un peu malodorant!
Glossaire
Alcalin: Avoir un pH supérieur à 7, indiquant une substance basique ou non acide.
Puits de carbone: Un puits de carbone est tout ce qui absorbe plus de carbone de l’atmosphère qu’il n’en libère – par exemple les plantes, les océans et le sol.
Échantillon de contrôle: Dans une expérience, un contrôle est quelque chose qui reste volontairement inchangé. Il est utilisé comme norme pour comparer d’autres résultats.
Inorganique: Composé de matière non vivante.
Acidification de l'océan: Processus par lequel l'océan absorbe le dioxyde de carbone de l'atmosphère, entraînant une diminution du pH et une augmentation de l'acidité de l'océan. Cela peut avoir des effets négatifs sur la vie marine et les écosystèmes.
Biologique: Composé de matière vivante.